Introducción
El cáncer de mama es el tumor más frecuente que afecta a la población femenina en España, con una frecuencia de 1 de cada 8 mujeres[1]. Cómo sabemos es una enfermedad heterogénea que necesita de un tratamiento personalizado, en función del tamaño, afectación de la enfermedad a nivel axilar o a distancia, y el subtipo histológico y molecular que nos definirán el esquema terapéutico a seguir[2]. Desde la implementación de la radioterapia se ha establecido cómo tratamiento quirúrgico gold estándar la cirugía conservadora que, con los mismos resultados oncológicos, es decir, sin aumentar el riesgo de recidiva ni alterar las tasas de supervivencia, presenta beneficios como menor dolor postoperatorio, recuperación más precoz, menor alteración de la imagen corporal, lo que se traduce en una mejor calidad de vida. Además, en la mayoría de los casos, son intervenciones que se realizan en régimen de cirugía ambulatoria, sin requerir ingreso hospitalario, lo que también disminuye los costes hospitalarios.
El auge de la cirugía conservadora está en relación con la detección del cáncer en estadíos precoces gracias a la mamografía de cribado y la mejora de las pruebas de imagen, la cirugía oncoplástica que permite la conservación de la mama en tumores de mayor tamaño con un buen resultado estético, y los tratamientos neoadyuvantes que consiguen en un amplio porcentaje una respuesta favorable o completa[3].
De todos los tumores diagnosticados de mama, un 20-35 % serán lesiones no palpables que se han identificado en la prueba de cribado. La cirugía de estas lesiones supone un reto para el cirujano que necesita un método de localización prequirúrgico para conseguir su exéresis sin quitar exceso de tejido y conseguir un buen resultado estético[4]. La localización con arpón ha sido durante muchos años la técnica de referencia para el marcaje de estas lesiones desde 1970. El arpón se coloca la mañana de la cirugía para disminuir las molestias que genera, y minimizar el riesgo de migración, prolongando los tiempos de espera el día de la intervención y añadiendo más ansiedad a la paciente en este proceso. Los inconvenientes del mismo han propiciado el desarrollo de nuevos métodos de localización como la semilla magnética, la semilla radiactiva o la tecnología radar[5]. De este último método, hablamos en este trabajo, explicando su funcionamiento, comparando las ventajas con respecto a otros métodos y, también, de la experiencia en nuestro hospital.
¿En qué consiste la localización radar?
SAVI SCOUT® es el método de localización no radiactivo más reciente que se usa para localización de lesiones no palpables en tejido blandos desde 2014. Puede utilizarse para marcar tanto lesiones en mama como en ganglios, que en el contexto de la neoadyuvancia nos proporciona una herramienta segura para realizar la disección axilar dirigida y así poder resecar el ganglio clipado.
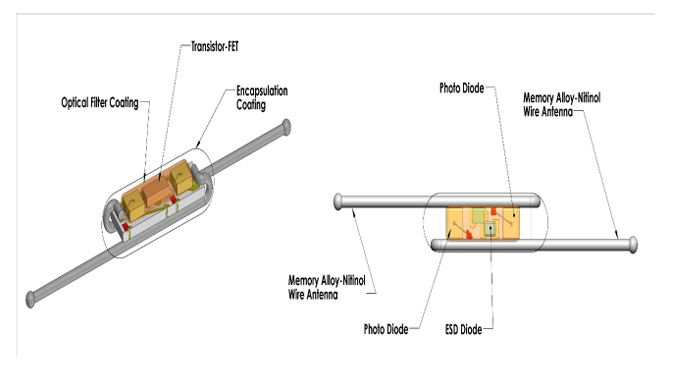
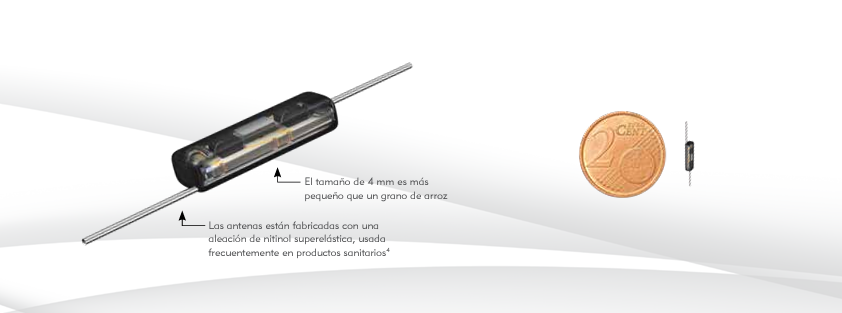
El reflector que se coloca en la lesión está compuesto de nitinol (níquel + titanio), y contiene un circuito formado por un diodo y dos antenas[6]. El diodo mide 4 mm, del tamaño de un grano de arroz, y en su conjunto con las antenas 1.2 cm. Con la sonda de mano envíamos dos señales: en primer lugar, una señal de infrarrojos que cierra y activa el circuito del reflector para que devuelva la segunda señal emitida por la sonda, la señal radar. Esta señal nos proporciona un marcaje de la lesión en tiempo real con un margen de precisión de +/- 1 mm. El rango de detección es de 360º, y la distancia máxima detectada de profundidad es de 60 mm. En la consola nos marcará la distancia en milímetros a la que se encuentra el reflector, y además emitirá una señal auditiva que nos ayudará a conocer la orientación y distancia del dispositivo.
La implantación del scout puede realizarse en cualquier momento antes de la cirugía ya que no tiene límite de tiempo para su escisión, incluso puede colocarse el día de la biopsia sustituyendo al coil en lesiones altamente sospechosas y evitando un segundo proceso para su colocación una vez confirmada la histología[5]. La colocación se realiza con anestesia local en el punto de inserción con una aguja de 16G de ancho, la longitud de la misma va a depender del método que se use para guiarlo (ecografía o mamografía)[6]. Una vez colocado se realizará una mamografía en craneocaudal y mediolateral para comprobar la correcta colocación y la posición de Scout con respecto a la lesión. Una vez realizada la resección de la lesión, se puede comprobar in situ los márgenes fuera de la paciente, pudiendo corregir en el momento una posible ampliación de algún margen, ahorrando tiempo y disminuyendo riesgo de reintervención. Posteriormente, se comprueba la pieza por mamografía para ver que el Scout y la lesión se han resecado y que los márgenes son correctos.
Componentes
1. Consola: emite la señal radar e infrarrojos(IR). En la pantalla muestra la distancia en tiempo real y emite señal acústica que nos ayuda a la orientación del dispositivo dentro del tejido que está colocado
2. Sonda de mano: transmite la señal radar e IR desde la consola hasta el tejido.
3. Reflector. Tamaño de 4 mm (1.2 cm con las antenas). Contiene un diodo y dos antenas de aleación metálica (nitinol). Una vez activado con señal de infrarrojos devuelve la señal radar.
4. Dispositivo de colocación: 16 G de ancho, dependiendo de la técnica empleada (ecografía o estereoataxia) con un largo de 5, 7,5 y 10 cm. Se coloca anestesia local en el punto de inserción.
Ventajas y desventajas de este método de localización
Si comparamos la localización radar con el arpón, las pacientes refieren menos molestias en la colocación del scout, además de no presentar prácticamente riesgo de migración (<1%). El hecho de poder colocarse en cualquier momento previo a la intervención quirúrgica, ya que no existe actualmente límite de tiempo para extraerlo, disminuye el tiempo de espera y los procesos realizados el mismo día de la intervención, lo que minimiza la ansiedad de la paciente. También, al poder colocarse el día de la biopsia en lesiones altamente sospechosas (BIRADs 5), nos evitaría un segundo procedimiento6. Todo ello mejora la tasa de satisfacción de las pacientes, que lo recomiendan hasta en un 97%[7].
Proporciona una medición en tiempo real, que permite definir la localización de la lesión con una precisión de +/- 1mm. Una vez extraída la pieza podemos valorar los márgenes previamente a la realización de la mamografía, y ver si precisa la extirpación de más tejido, lo que disminuye la tasa de reintervención por márgenes afectos. Ofrece una señal tanto visual de la distancia, como auditiva.
Desde el punto de vista del cirujano, mejora la planificación quirúrgica ya que el dispositivo está puesto con antelación y la paciente preparada para la intervención, por lo que podemos realizar una mejor programación, disminuyendo los tiempos de espera, y con un mejor aprovechamiento de quirófano permitiendo incluir a más pacientes en el mismo día. A diferencia del arpón, nos permite elegir el lugar de la incisión quirúrgica lo que mejora los resultados estéticos y la realización de oncoplastia[8]. Al desvincular la implantación del dispositivo con la retirada, permite la independencia organizativa entre los servicios de Radiología y Cirugía, lo que se traduce en resultados más eficientes. Además, presenta una pequeña curva de aprendizaje.
El reflector es visible y puede identificarse tanto por ecografía, mamografía como resonancia[9]. Prácticamente no produce artefacto en la resonancia, por lo que en el contexto de la neoadyuvancia puede utilizarse, ya que en estas pacientes suele realizarse una resonancia de seguimiento tras finalizar el tratamiento para valorar la respuesta. En el caso de lesiones grandes o multifocales, pueden utilizarse varios reflectores siempre que exista una distancia mínima de 15 mm entre ellos.
Si comparamos con otros métodos con la semilla magnética[10], Scout no tiene ninguno de sus componentes magnetizados, por tanto, su empleo es compatible con el material estándar de quirófano y no es necesario emplear material especial de plástico, lo que permite un ahorro de costes y además mantiene la familiaridad del personal de quirófano con su material habitual. Con respecto a la semilla radiactiva[11], Scout no irradia y, por tanto, no es necesario establecer protocolos de manejo y desecho del localizador. La semilla radiactiva no puede colocarse más de 5-7 días antes de la intervención, por lo que no es posible colocarlo con tiempo y en el escenario de la neoadyuvancia, y la tasa de migración es más alta (7-12%).
Cox C[7]. lleva a cabo un estudio prospectivo, multicéntrico dónde incluye 154 pacientes con lesiones no palpables en mama localizadas mediante Scout. La intervención transcurrió con éxito en 153/154 casos, teniendo que utilizar el arpón en una lesión situada a una profundidad mayor dónde el reflector no era detectado. De todas estas pacientes, 101 casos tenían un diagnóstico de malignidad, y la tasa de afectación de márgenes fue de un 16.8%, con una evaluación positiva tanto por los cirujanos, radiólogos y pacientes.
También se ha constado en los trabajos una disminución en la tasa de afectación de márgenes, disminuyendo así la tasa de reintervención. Shirazi S[12]. en su trabajo incluye 34 estudios que comparan la tasa de márgenes positivos y necesidad de re-escisión entre las técnicas nuevas y el arpón. En concreto son 5 los estudios que comparan la técnica radar con el arpón, siendo en su mayoría de un sólo centro y observacionales, pero que analizando los resultados en conjunto presenta una menor tasa de márgenes positivos (10.6% vs. 15% p= 0.0105) y tasa de re-escisión (8.6% vs. 18.8% p= 0.0001), reduciendo hasta en un 10.2% en el grupo SAVI SCOUT de un total de 1388 pacientes incluidos. Concluye que se necesitan estudios prospectivos y con mayor número de pacientes para comprobar los resultados.
En cuanto a los inconvenientes de la técnica podemos citar que no se puede utilizar en pacientes alérgicas al níquel o titanio ya que está compuesto de nitinol. No es útil en lesiones profundas, mamas grandes o pacientes obesas donde el localizador esté a más de 60 mm de la piel. Si la colocación no ha sido correcta, no podemos reubicarlo, habría que usar otro nuevo dispositivo. Este dispositivo puede dañarse con la diatermia, por lo que quedaría inactivado. Por lo tanto, hay que hacer un uso cuidadoso del bisturí eléctrico en las inmediaciones del localizador.
Tabla 1
Ventajas de método radar.
En cuanto al coste, presenta un precio más elevado que el arpón, pero si incluimos otros gastos indirectos hospitalarios, creemos que el beneficio supera al precio del mismo. Se ha descrito menor tasa de reintervención, menos tasa de suspensión de quirófano y demora, mayor eficiencia en el flujo de trabajo, y además si se coloca el día de la biopsia, elimina un procedimiento.
Tabla 2
Inconvenientes de método radar.
Los últimos resultados presentados en ASCO 2024 por la autora Maggie Banys-Paluchowski[14] defienden el scout como una herramienta útil para el marcaje del ganglio axilar metástasico previo a la neoadyuvancia para la realización de la disección axilar dirigida en pacientes con respuesta favorable al tratamiento. Los resultados de estas pacientes incluidas dentro del ensayo AXSANA tienen una tasa de detección y escisión muy alta, por lo que en espera de series prospectivos más amplias parece ser una herramienta válida. Incluyen a 137 pacientes cN1 con el ganglio marcado con scout previo al tratamiento neoadyuvante. El 86.9 %(119/137) ya se han operado, el resto continúa el tratamiento. Todos los marcadores han sido retirados, y 117 contenían en ganglio clipado. En dos casos sólo se obtuvo el marcador con grasa, sin obtener tejido linfático en la muestra, no está claro, pero seguramente por migración del reflector.
Nuestra experiencia
Comenzamos esta aventura en mayo de 2023, siendo el primer centro de Andalucía en utilizar este dispositivo, y uno de los primeros a nivel nacional. Desde el 1 de mayo de 2023 al 30 de abril de 2024, hemos intervenido a 170 pacientes con una mediana de edad de 58 años. En total hemos retirado 194 dispositivos 160 en mama y 34 en axila en el contexto de la neoadyuvancia y la TAD axilar, y dos casos de exéresis de adenopatías axilares para biopsia escisional para descartar diagnóstico de linfoma. Tan sólo en un caso con una paciente con mama grande y obesidad, tuvimos que marcar la lesión y el scout con arpon debido ya que la lesión se encontraba a más de 60 mm de profundidad. El diagnóstico histológico de malignidad se confirmó en 161/170 pacientes (94%). Nuestra tasa de afectación de márgenes fue del 9% (16/170). Nuestra apreciación es que necesita de una curva de aprendizaje corta, y nos ha beneficiado sobre todo en la independencia con otros servicios y aprovechamiento de quirófano. Tanto para el servicio de Radiodiagnóstico como para nosotros, la impresión ha sido buena, y seguimos trabajando en la misma línea.
Conclusiones
La tecnología radar para la localización de lesiones no palpables en mama ha demostrado ser una técnica segura y fiable con una alta tasa de detección y un bajo porcentaje de afectación de márgenes. Por parte de las pacientes, el hecho de poder colocarlo con antelación a la cirugía disminuye el tiempo de espera antes de la intervención, lo que se traduce en una menor ansiedad relacionada con el proceso, mejorando la satisfacción de la paciente. A nosotros los cirujanos nos permite una mejor planificación quirúrgica, disminuyendo la demora en los tiempos de quirófano promoviendo una mejor utilización de los recursos y la independencia entre los servicios de cirugía y rayos, con mejores flujos de trabajo. El hecho de poder elegir la incisión cutánea ha mejorado los resultados estéticos. Aunque se necesitan estudios prospectivos con mayor número de pacientes, han disminuido las tasas de afectación de márgenes y de reintervención. Por todo ello, creemos que es un método útil en la localización de lesiones mamarias no palpables y ganglios axilares en el contexto de la neoadyuvancia.